Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
junio 5, 2025
Perspectivas CIRCOVIRUS PORCINO
MVZ. Víctor Manuel Carrera Aguirre; MVZ. José de Jesús Hernández Ascencio; MVZ. Jesús Munguía Rosas
Los circovirus porcinos incluyen cuatro pequeños virus de ADN monocatenario: PCV1, PCV2, PCV3 y PCV4. Estos virus sin envoltura pertenecen al género Circovirus y a la familia Circoviridae [Rosario K., et., al. 2017] . Actualmente, sólo el PCV2 y el PCV3 se consideran patógenos y responsables de problemas sanitarios en la industria porcina. El PCV2 se ha notificado en todo el mundo y es responsable de las circovirosis porcinas y de las enfermedades asociadas a circovirus porcino en cerdos [Segales J. 2012]. PCV3 se notificó por primera vez en EE.UU. en 2015 en una granja con alta mortalidad y bajas tasas de concepción. Desde ese informe, el virus se ha notificado en muchos países de Europa, Asia y América. [Palinski, R et., al. 2017].
Esta revisión tiene como objetivo, proporcionar una comprensión actualizada de la biología del circovirus porcino y sus enfermedades asociadas.
CIRCOVIRUS PORCINO, UN VIRUS PARTICULAR DESDE SU ESTRUCTURA Y EVOLUCIÓN MOLECULAR.
El Circovirus Porcino (PCV), un patógeno viral ubicuo que afecta a los cerdos. Este virus pertenece al género Circovirus y a la familia Circoviridae y es responsable de la enfermedad asociada al circovirus porcino (PCVAD), que incluye una serie de enfermedades como el síndrome de emaciación multisistémica post-destete (PMWS), el síndrome de dermatitis y nefropatía porcina (PDNS), la enteritis granulomatosa, el complejo respiratorio porcino, el fallo reproductivo y el edema agudo de pulmón [Cino-Ozuna et., al. 2011].
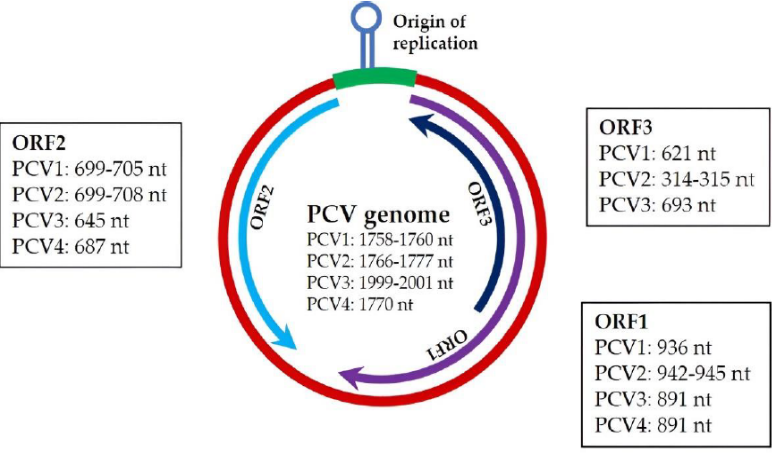
Imagen 1. Organización genómica del Circovirus Porcino y su similitud entre diferentes tipos.
El PCV es un virus de ADN circular monocatenario, icosaédrico, pequeño, no envuelto, con un diámetro que oscila entre 13 y 25 nm. [Maity, H.K et., al 2023] Ver Imagen 1
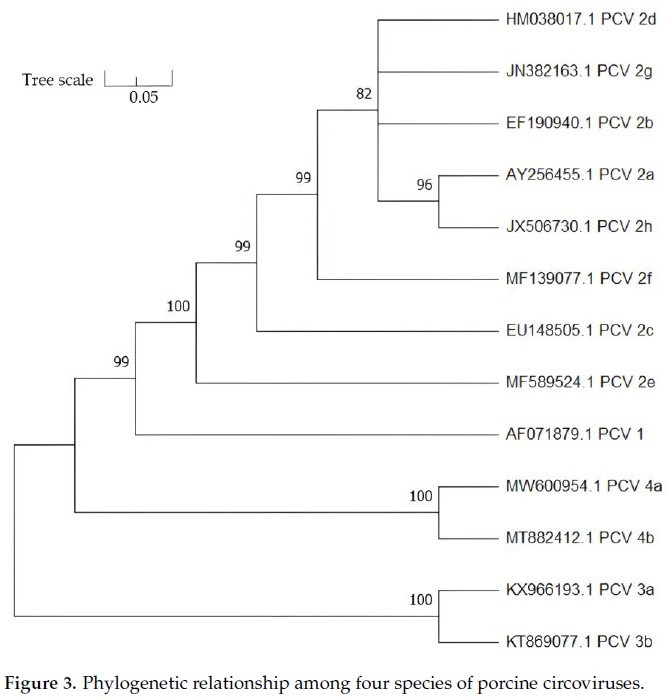
A pesar de su pequeño tamaño y su genoma sencillo, el PCV2 muestra una notable plasticidad genética, facilitada por una elevada tasa de mutación y recombinación. Tabla 1.
- ORF1
Codifica dos proteínas asociadas a la replicación (rep y rep0) que son esenciales para la multiplicación del genoma del PCV2 pero que están ausentes en el virión ensamblado.
- ORF2
Codifica una proteína de cápside viral (cap), la única proteína estructural. La proteína de la cápside (cap) determina la antigenicidad y virulencia del PCV2 y la mutación de uno o dos de sus aminoácidos puede afectar a esta virulencia y patogenicidad. Por otra parte, el ORF2 por si solo puede servir como marcador filogenético y epidemiológico para el análisis comparativo del PCV2.
- ORF 3
No es esencial para la replicación del virus, pero puede modular las respuestas inmunes del huésped y la apoptosis (muerte celular programada).
Tabla 1: Similitudes genómicas (%) entre los circovirus porcinos
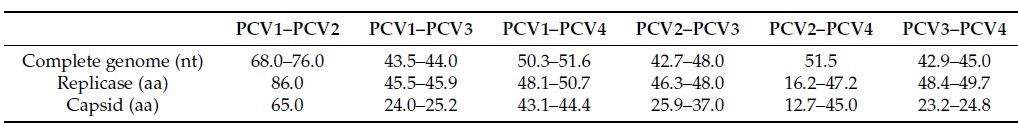
El PCV2 tiene ocho genotipos, del PCV2a al PCV2h [Franzo, G and Segales, J 2018]. Recientemente, también se ha descubierto en EE.UU. un nuevo genotipo designado como PCV2i [Wang, Y et., al 2020]. La enorme diversidad genética del PCV2 se debe a su mayor tasa evolutiva (~1,2 10x3 sustituciones/sitio/año), como la de los virus ARN [Firth, C et., al. 2009]. Entre los nueve genotipos, se han encontrado tres genotipos principales, a saber, PCV2a, PCV2b y PCV2d, en todo el mundo, mientras que otros tienen una distribución restringida [Wang, Y et., al 2020] Ver Imagen 2.
Imagen 2. Presencia mundial de diferentes genotipos de PCV
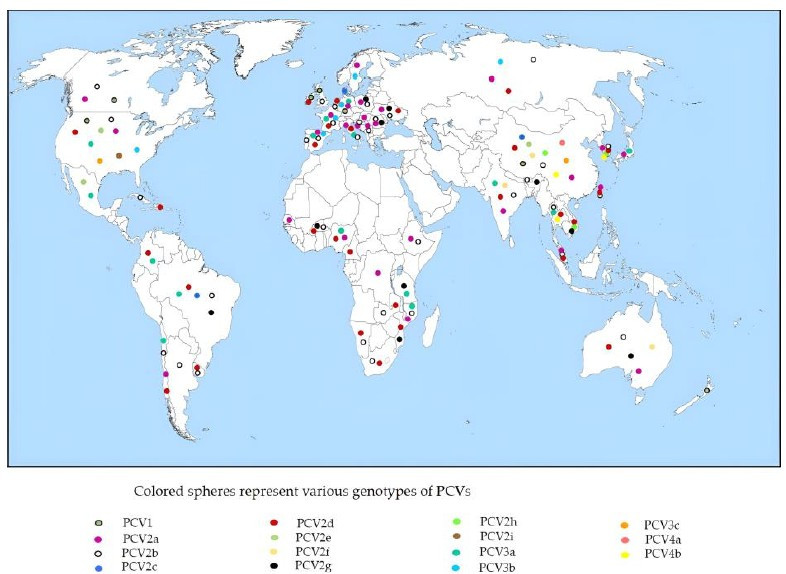
Imagen 3. Relación filogenética entre cuatro especies de circovirus porcino.
Además, el PCV2a tiene cinco clusters (2A-2E), el PCV2b tiene tres clusters (1A-1C), y el PCV2d tiene dos subgenotipos (2d-1, 2d-2) El PCV2a fue el genotipo dominante hasta 2003, tras lo cual el PCV2b emergió como el genotipo predominante en todo el mundo [Xiao, C; Halbur, P; Opriessnig, T. 2015].
La relación genética y evolutiva entre las diferentes especies de PCV (PCV1, PCV2, PCV3 y PCV4) se ilustra en un árbol filogenético basado en las secuencias genéticas del marco abierto de lectura 2 (ORF2) de los PCV recuperadas de GenBank Ver Imagen 3.
A pesar de que el PCV2 suele considerarse un virus sencillo, su origen genético y trayectoria evolutiva han demostrado ser complejos. Este fenómeno se ha atribuido a la ventaja competitiva que algunos grupos genéticos o variantes pueden haber adquirido en entornos específicos, probablemente por diferencias en la virulencia, el tropismo, la tasa de replicación o la protección cruzada.
Históricamente, el PCV2a fue el primer genotipo en ser ampliamente reconocido, siendo el dominante hasta que fue sustituido por el PCV2b a inicios de los 2000. Alrededor de 2010, apareció el PCV2d que se convirtió en el genotipo más prevalente a escala mundial, al menos hasta la actualidad. A pesar de que la aplicación generalizada de las vacunas basadas en el PCV2a ha sido decisiva a la hora de reducir la enfermedad clínica y mejorar la salud de los animales, estas vacunas también han modelado el panorama evolutivo del PCV2. Se ha propuesto que la protección cruzada diferencial entre los genotipos, incluso marginal, influye en la evolución y la dinámica de los genotipos del PCV2, lo que favorece la aparición de variantes y genotipos que son neutralizados de forma menos eficiente por la inmunidad vacunal.
Si bien los llamados “cambios de genotipo” del PCV2a al PCV2b y, posteriormente, al PCV2d están bien documentados, se sabe menos acerca de la persistencia y el resurgimiento periódico de genotipos anteriores.
DATOS SOBRE LA VACUNACIÓN dE CIRCOVIRUS PORCINO
La primera vacuna comercial contra el PCV2 se introdujo en 2006 en E.U. desde entonces, hay productos comerciales disponibles. Todas las vacunas recombinantes se dirigen a la proteína inmunógena de la cápside del virus codificada por el marco abierto de lectura 2 (ORF2), mientras que las vacunas convencionales inactivadas son preparaciones de virus entero [Beach y Meng, 2012]. Durante la última década, se han acumulado datos de campo que demuestran incuestionablemente la eficacia de estas vacunas comerciales, como lo demuestra la mejora de la ganancia diaria de peso y las ganancias económicas en los cerdos vacunados contra PCV2 en comparación con los cerdos no vacunados. Dado que el PCV2 es un importante agente coinfectante, se cree que la vacunación contra el PCV2 confiere beneficios no intencionados en la protección contra los otros agentes también [Chae, 2016].
El éxito de las vacunas contra el PCV2 es aún más notable debido al hecho de que la vacunación se realiza frente a la infección en cerdas o en presencia de anticuerpos maternos en lechones.
Las vacunas contra el PCV2 que existen en el mercado han permitido controlar la enfermedad clínica de forma eficaz, pero, sin embargo, cada vez son más las diferencias genéticas observadas entre el virus y las vacunas disponibles actualmente. Esto es así porque en Europa temporalmente todas las vacunas se basan en un solo genotipo, el PCV2a, a pesar de que hoy en día los virus más prevalentes pertenecen a otros genotipos: el PCV2b y, en especial, el PCV2d.
Debido a la evolución que ha tenido el virus durante los últimos años, se ha visto que el sitio ORF-2 ha tenido diferencias entre los subtipos de PCV2a y el PCV2d. Por lo cual múltiples y distintas investigaciones de las vacunas disponibles en el mercado buscan comprobar su protección en ambos subtipos.
El uso extendido de las vacunas basadas en el PCV2a ha sido señalado como factor que ha contribuido a este fenómeno. Sin embargo, pese a que han transcurrido casi dos décadas desde la introducción y la aplicación generalizada de las vacunas frente al PCV2a, tanto el PCV2a como el PCV2b siguen detectándose, aunque en frecuencias inferiores y variables. Los escenarios han cambiado y hoy en día el genotipo PCV2d es el más dominante.
COINFECCIONES PCV2 Y PCV3
Hasta la fecha, se desconocen los mecanismos exactos de la coinfección por circovirosis [Ren, L.; Chen, X. and Ouyang, H. 2016]. Sin embargo, muchos estudios han señalado que la coinfección con otros patógenos porcinos, como el virus del síndrome respiratorio y reproductivo porcino (PRRS), el parvovirus porcino (PPV), el virus de la gripe porcina (SIV), Mycoplasma hyopneumoniae y Salmonella spp., son cofactores importantes que pueden potenciar la infección por PCV2 y la gravedad de la circovirosis [Ren, L.; Chen, X. and Ouyang, H. 2016]. Además, los fallos de vacunación, el estrés o el hacinamiento junto con animales infectados por PCV2 también, causan circovirosis [Ellis, J 2014].
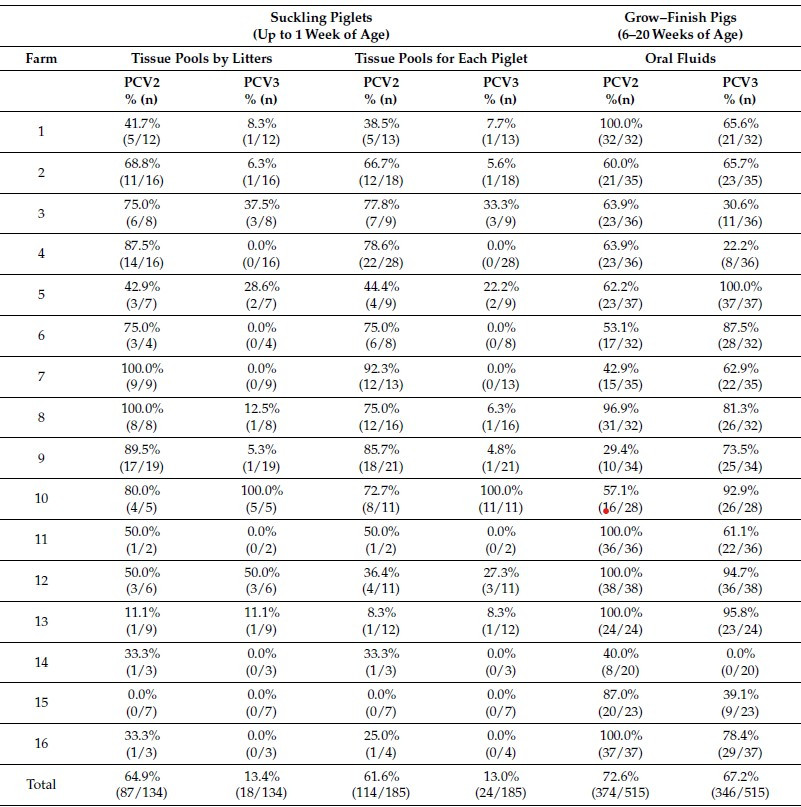
La transmisión vertical es una vía constantemente discutida de transmisión del PCV2 y del PCV3 en cerdos. En un estudio que se realizó en Alemania y Austria se tomaron muestras de tejido linfoide, miocardio, pulmón y bazo en lechones, así como fluidos orales en cerdos de engorda para PCV2 y PCV3 mediante qPCR. En los lechones, el PCV2 era muy prevalente (camadas: 69,4%; lechones: 61,6%), mientras que la prevalencia del PCV3 era baja (camadas: 13,4%; lechones: 13,0%). En total, el 72,6% y el 67,2% de todas las OFS recogidas fueron PCV2 o PCV3 positivas, respectivamente. [Eddicks, M et., al. 2022]. Ver Tabla 2
Tabla 2 Muestras positivas para PCV2 y PCV3 en camadas, lechones y fluidos orales (n/%)
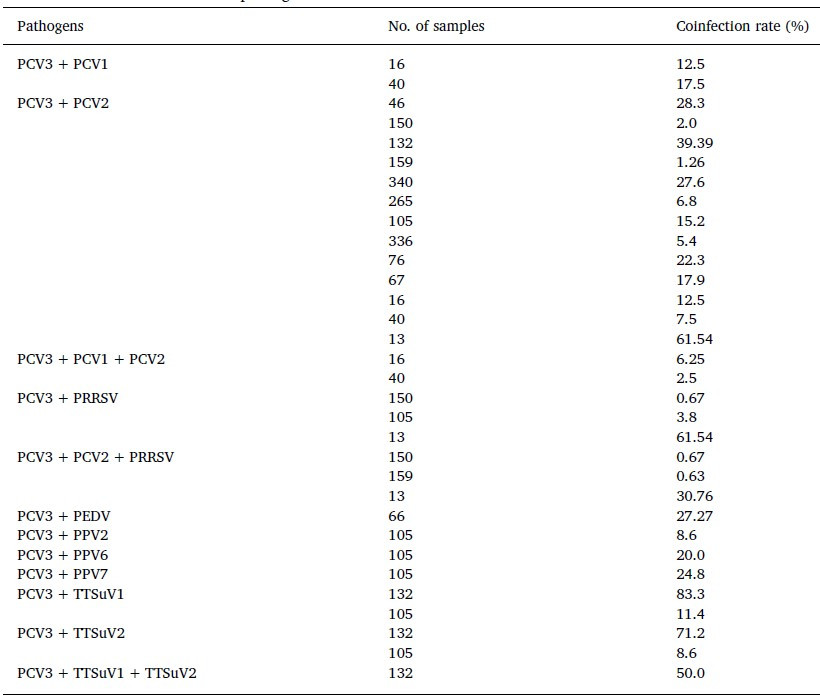
Por otra parte, las coinfecciones de PCV3 con otros virus también han sido investigadas. Los resultados mostraron que las muestras positivas para PCV3 tienen altas tasas de coinfección con PCV2, PRRSV, virus de la diarrea epidémica porcina (PEDV) o parvovirus porcino (PPV). Ver Tabla 3. Estos resultados revelan que las coinfecciones de PCV3 con otros agentes son comunes en las piaras de cerdos. [Ting O. et., al. 2019]
Tabla 3 Coinfecciones de PCV3 con otros patógenos.
COMENTARIOS
Esta información conlleva a implicaciones significativas en las futuras estrategias de control, ya que, aunque el PCV2d sigue siendo el genotipo más prevalente y extendido, el papel potencial de otros genotipos no se debería dejar de lado. Sugerimos continuar con programas de inmunización preventiva, ya que es una herramienta eficaz en el control de la enfermedad, reducción de los signos clínicos y limitar el potencial evolutivo del PCV2. La dinámica de infección y los cambios evolutivos han favorecido la interacción de agentes coinfectantes que exacerban la productividad de los animales. Actualmente, hay mayor disponibilidad de datos de secuencias que han permitido explorar de forma más exhaustiva la epidemiología y la evolución molecular del PCV2, además de recalcar la necesidad de una vigilancia continua.
REFERENCIAS BIBLIOGRAFICAS
- Beach, N.M., Ramamoorthy, S., Opriessnig, T., Wu, S.Q., Meng, X.J., 2010. Novel chimeric porcine circovirus (PCV) with the capsid gene of the emerging PCV2b subtype cloned in the genomic backbone of the non-pathogenic PCV1 is attenuated in vivo and induces protective and cross-protective immunity against PCV2b and PCV2a subtypes in pigs. Vaccine 29, 221-232
- Cino-Ozuna, A.G.; Henry, S.; Hesse, R.; Nietfeld, J.C.; Bai, J.; Scott, H.M.; Rowland, R.R.R. Characterization of a new disease syndrome associated with porcine circovirus type 2 in previously vaccinated herds. J. Clin. Microbiol. 2011, 49, 2012–2016.
- Chae, C., 2016. Porcine respiratory disease complex: Interaction of vaccination and porcine circovirus type 2, porcine reproductive and respiratory syndrome virus, and Mycoplasma hyopneumoniae. Veterinary journal 212, 1-6.
- Ellis, J. Porcine circovirus: A historical perspective. Vet. Pathol. 2014, 51, 315–327.
- Eddicks, M.; Maurer, R.; Deffner, P.; Eddicks, L.; Sipos,W.; Reese, S.; Cvjetkovi´c, V.; Krejci, R.; Opriessnig, T.; Ritzmann, M.; et al. Cross-Sectional Study on the Prevalence of PCV Types 2 and 3 DNA in Suckling Piglets Compared to Grow–Finish Pigs in Downstream Production. Pathogens 2022, 11, 671.
- Franzo, G.; Segal’es, J. Porcine circovirus 2 (PCV-2) genotype update and proposal of a new genotyping methodology. PLoS ONE 2018, 13, e0208585.
- Firth, C.; Charleston, M.A.; Duffy, S.; Shapiro, B.; Holmes, E.C. Insights into the evolutionary history of an emerging livestock pathogen: Porcine circovirus 2. J. Virol. 2009, 83, 12813–12821
- Maity, H.K.; Samanta, K.; Deb, R.; Gupta, V.K. Revisiting Porcine Circovirus Infection: Recent Insights and Its Significance in the Piggery Sector. Vaccines 2023, 11, 1308.
- Palinski, R.; Piñeyro, P.; Shang, P.; Yuan, F.; Guo, R.; Fang, Y.; Byers, E.; Hause, B.M. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure. J. Virol. 2017, 91, 10–1128.
- Rosario, K.; Breitbart, M.; Harrach, B.; Segalés, J.; Delwart, E.; Biagini, P.; Varsani, A. Revisiting the taxonomy of the family Circoviridae: Establishment of the genus Cyclovirus and removal of the genus Gyrovirus. Arch. Virol. 2017, 162, 1447–1463.
- Ren, L.; Chen, X.; Ouyang, H. Interactions of porcine circovirus 2 with its hosts. Virus Genes 2016, 52, 437–444.
- Segalés, J. Porcine circovirus type 2 (PCV2) infections: Clinical signs, pathology and laboratory diagnosis. Virus Res. 2012, 164, 10–19.
- Ting Ouyang, Guyu Niu, Xiaohua Liu, Xinwei Zhang, Ying Zhang, Linzhu Ren. Recent progress on porcine circovirus type 3. Infection, Genetics and Evolution 73 (2019) 227–233
- Wang, Y.; Noll, L.; Lu, N.; Porter, E.; Stoy, C.; Zheng,W.; Liu, X.; Peddireddi, L.; Niederwerder, M.; Bai, J. Genetic diversity and prevalence of porcine circovirus type 3 (PCV3) and type 2 (PCV2) in the Midwest of the USA during 2016–2018. Transbound. Emerg. Dis. 2020, 67, 1284–1294
- Xiao, C.T.; Halbur, P.G.; Opriessnig, T. Global molecular genetic analysis of porcine circovirus type 2 (PCV2) sequences confirms the presence of four main PCV2 genotypes and reveals a rapid increase of PCV2d. J. Gen. Virol. 2015, 96, 1830–1841.
Comentarios (0)


 Español
Español  Inglés
Inglés 
